Medikamentenversuche an Kurkindern
Planet Wissen. 22.07.2024. 05:03 Min.. UT. Verfügbar bis 07.10.2027. SWR.
Pharmaindustrie
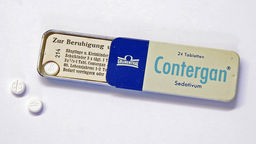
Der Fall Contergan
Anfang der 1960er-Jahre wurden in Deutschland plötzlich viele Kinder geboren, denen Arme oder Beine fehlten oder zu kurz waren. Dann wurde klar, dass das Schlafmittel Contergan die Fehlbildungen verursachte. Es folgte der weltweit größte Arzneimittelskandal.
Die fehlgebildeten Kinder
Die Fortschritte der Medizin und Pharmaindustrie des 19. und 20. Jahrhunderts hatten eine Kehrseite: Es war nur eine Frage der Zeit, wann ein neu zugelassenes Medikament ungeahnte Nebenwirkungen hervorrufen würde, die sich auf den Patienten schädigend, im schlimmsten Fall sogar tödlich auswirken würden.
In den Jahren 1960 und 1961 wurden in den Kliniken der Bundesrepublik immer mehr Kinder geboren, deren Hände, Arme, Füßen oder Beinen fehlgebildet waren oder ganz fehlten.
Die Fehlbildungen an den Extremitäten gingen einher mit irreparablen Nervenschäden, außerdem mit Fehlbildungen an Ohren und den inneren Organen. In Münster, Hamburg, Marburg, Bonn und Kiel rätselten Forscher über die mysteriösen Anomalien und bemühten sich, den Grund dafür herauszufinden.
Der Hamburger Kinderarzt Widukind Lenz kam schließlich der Ursache auf die Spur. Im Juni 1961 war Lenz erstmals darauf aufmerksam geworden, dass sich die Gliedmaßenfehlbildungen bei Neugeborenen unnatürlich häuften.
Der Rechtsanwalt Karl-Hermann Schulte-Hillen hatte sich an den damaligen Direktor der Hamburger Universitätskinderklinik gewandt, um den Grund für die auffällige Behinderung seines Sohnes und seiner Nichte herauszufinden. Der Leiter der Klinik, Prof. Schäfer, zog Lenz zu dem Fall hinzu.
Als Schulte-Hillen den Medizinern eröffnete, dass in seiner Heimatstadt Minden die Missbildungsfälle gehäuft aufgetreten waren, war Lenz alarmiert – eine zuvor angenommene familiäre Erbkrankheit konnte also ausgeschlossen werden.
Lenz begann zu recherchieren und stellte fest, dass die vorliegende Fehlbildungshäufigkeit, die früher bei einem von 50.000 Kindern gelegen hatte, bundesweit auf 50 bis 100 pro 50.000 gestiegen war: Im Schnitt waren nun von je 1000 Neugeborenen ein bis zwei betroffen.

Kinder wurden mit verkürzten oder fehlenden Armen geboren
Der Contergan-Krimi
Im Herbst 1961 waren sich die meisten Forscher in Deutschland einig, dass die Fehlbildungen in unmittelbarem Zusammenhang zu einer eingenommen, toxischen Substanz stehen mussten. Lenz begann daher, junge Mütter mit geschädigten Kindern gezielt über ihre Schwangerschaftsgewohnheiten zu befragen, dabei konzentrierte er sich besonders auf eingenommene Arzneimittel während der frühen Schwangerschaftsphase.
Anfang November 1961 fand Lenz, wonach er suchte. In allen Fällen hatten die werdenden Mütter während der Schwangerschaft ein neuartiges, 1954 von der Aachener Pharmafirma Grünenthal synthetisiertes und seit 1957 angebotenes Schlafmittel zu sich genommen: Contergan.
Lenz schlug sofort Alarm. Am 15. November 1961 unterrichtete er telefonisch den Forschungsleiter der Firma Grünenthal, Heinrich Mückter, und forderte die Rücknahme des brisanten Präparates.
Das Gespräch verlief für Lenz wenig zufriedenstellend, woraufhin er in einem Einschreiben an die Firma Grünenthal seine Einschätzung des gefährlichen Arzneimittels wiederholte.
Am 19. November 1961 machte Lenz seinen Verdacht auf einem Vortrag der Vereinigung Rheinisch-Westfälischer Kinderärzte öffentlich. Am 20. November 1961 wurde Lenz von Vertretern der Firma Grünenthal in leitender Position aufgesucht, die ihm Rufmord vorwarfen und mit erheblichen juristischen Konsequenzen drohten.
Noch am gleichen Tag traf sich Lenz mit Grünenthal-Vertretern in der Hamburger Gesundheitsbehörde, erneut verweigerte Grünenthal die Zurücknahme des Medikaments. Am 26. November 1961 berichtete die "Welt am Sonntag" über den Vortrag von Dr. Lenz – am Tag darauf zog Grünenthal Contergan aus dem Verkehr.
Das ganze Ausmaß
Vier Jahre war das Schlafmittel Contergan auf dem Markt gewesen. Eingenommen während einer Schwangerschaft konnte es – schon bei einer einzigen Tablette – zu schwerwiegenden Schädigungen am ungeborenen Leben führen.
Weltweit wurden etwa 10.000 Kinder mit Fehlbildungen der Gliedmaßen geboren. Allein in Deutschland waren es 4000 bis 5000 Kinder mit schweren Behinderungen, von denen rund 3000 überlebten.
Der Strafprozess vor dem Landgericht Aachen gegen Verantwortliche der Firma Grünenthal wurde 1970 jedoch wegen geringer Schuld eingestellt.

Zum Prozess war Lenz als Sachverständiger geladen
1971 gründete die Bundesrepublik Deutschland gemeinsam mit der Firma Grünenthal eine Stiftung zur finanziellen Entschädigung der Opfer. Die Verantwortlichen der Grünenthal AG wurden strafrechtlich nie belangt.
Wäre die Contergan-Katastrophe vermeidbar gewesen? Das pharmazeutische Wissen der 1950er-Jahre reichte aus, um Zweifel an dem Wirkstoff Thalidomid aufkommen zu lassen, der dem Contergan-Präparat zugrundelag. Nicht auf allen Märkten war Contergan zugelassen worden.
In den USA etwa verweigerte die beherzte Mitarbeiterin der Zulassungsbehörde Frances Kelsey die Genehmigung für den US-Markt, trotz des erheblichen Drucks, der auf sie ausgeübt wurde.
Kelsey, die mit der Problematik der arzneilichen Stoffgruppe vertraut war, verlangte ausdrücklich Nachweise für die Unbedenklichkeit des Wirkstoffs auf die embryonale Organbildung in den ersten Wochen der Schwangerschaft. Für ihre Standhaftigkeit wurde sie später von John F. Kennedy persönlich geehrt.

In den USA verweigerte Frances Kelsey dem verhängnisvollen Schlafmittel die Zulassung
Die Frage der Arzneimittelsicherheit
Contergan war ohne ein öffentlich-rechtliches Zulassungsverfahren auf den Markt gebracht worden. Damals gab es noch kein Zulassungswesen in Deutschland, bei den Pharmakonzernen galt das Prinzip der Selbstüberwachung.
Dagegen stand das immens gestiegene Risikopotential der neu synthetisierten Stoffe, die seit den 1930er-Jahren in immer neuen Varianten und enormen Mengen in den Verkehr gebracht wurden. So waren Patienten und Konsumenten zugleich auch Versuchskaninchen, an denen sich effizient Wirkung und Nebenwirkung eines neuen Präparates erproben ließen.
Nach dem Contergan-Skandal wurden in Deutschland große Fortschritte auf dem Gebiet der organisatorischen Gewährleistung der Arzneimittelsicherheit erzielt. Besonders die Verabschiedung eines umfassenden Arzneimittelgesetzes sorgt bis heute für strenge Auflagen bei der Zulassung eines neuen Medikamentes. In klinischen Studien müssen neue Präparate erst umfassend am Menschen getestet werden, bevor sie auf den Markt kommen können.
Medikamente müssen auf Nebenwirkungen getestet werden
Der Contergan-Skandal war der bisher größte Pharma-Schock, der die Welt erschütterte. Aber verhängnisvolle Medikamente hatte es auch früher schon gegeben. In den USA starben im Jahr 1937 mehr als 100 Patienten, darunter 34 Kinder, nach Einnahme des Erkältungsmittels Sulfanilamid, das mit einem hochgiftigem Frostschutzmittel verunreinigt war. Daraufhin wurde in den USA 1938 die Arzneimittelrichtlinie "Federal Food, Drug and Cosmetic Act" erlassen.
Beim Skandal um die HIV-infizierten Blutkonserven in den 1980er-Jahren war der Auslöser ein Mangel an Erfahrungswerten. Das HI-Virus und die Krankheit AIDS waren damals völliges Neuland, unbekannt in seiner Übertragung und seiner Wirkung. Den verseuchten Blutpräparaten fielen 2000 Menschen zum Opfer.
Auch 2005 kam es zu einem Pharma-Skandal. Sechs britische Testpersonen waren nach Einnahme des Medikaments TGN1412 der Würzburger Firma TeGenero an schweren Entzündungen erkrankt, bei einigen führte das Präparat sogar zu Organversagen, die sechs Probanden fielen ins Koma. Das Medikament hätte gegen Leukämie, Arthritis und Multiple Sklerose eingesetzt werden sollen.
(Erstveröffentlichung 2006. Letzte Aktualisierung 01.04.2020)
Quelle: SWR